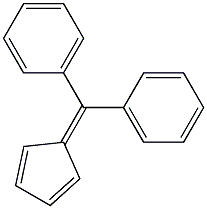
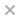合成路线
氢化反应过程中明显地存在一个速度梯度。开始的一段时间吸氢速度较快,而后速度显著减慢。这与在tP和Pd催化下的加氢反应类似。当吸氢速度刚开始减慢时,加水淬灭反应,分离得到1分子氢加成到环外双键的产物取代环戊二烯(A)。这说明环外双键的加氢活性比环内双键的高。
图2为6,6-二苯基富烯合成路线步骤1。
第二分子氢可加到(A)的环内离取代基远的双键上,但反应速度较慢,生成取代环戊烯(B)。(B)的环内双键移位到环外而成异构体(C)。延长反应时间和适当增大催化剂用量并不能导致取代环戊烷的生成,这说明取代环戊烯(B)和(C)在此条件下不易进一步氢化。这与文献结果一致。
图3为6,6-二苯基富烯合成路线步骤2。
最终产物的1H NMR谱表明,处于平衡状态的(A)、(B)、(C)相对摩尔比为14:64:23.在本文实验条件下,6,6一二苯基富烯的苯基不发生氢化。